La química es la ciencia que estudia la ……………………., ………………….., y …………………………… de la materia y la ……………………….. asociada a ellas.
|
Los fenómenos de la naturaleza y las leyes que los rigen
| |
Los cambios que experimentan las sustancias
| |
La composición de las sustancias
|
cuáles son los componentes de la sangre humana
| |
en qué proporción se encuentran los gases tóxicos que hay en el aire
| |
creación de la vacuna contra el sida
|
La energía asociada a los cambios en la materia
| |
Estudia las características de los materiales
| |
busca la piedra filosofal
|
Grafica los siguientes átomos. Indica las partículas subatómicas y, sus cargas eléctricas
10.81
|
2
|
B
|
3
|
5
|
6.94
|
2
|
Li
|
1
|
3
|
Elemento
|
Símbolo
|
Z
|
A
|
protones
|
Electrones
|
neutrones
|
Calcio
|
||||||
Azufre
|
||||||
Aluminio
|
||||||
Plata
|
||||||
Oro
|
||||||
Cloro
|
||||||
Yodo
|
||||||
Platino
|
Elemento
|
1°
|
2°
|
3°
|
4°
|
5°
|
Aluminio
|
|||||
Cobre
|
|||||
Fósforo
|
|||||
Magnesio
|
|||||
Manganeso
|
|||||
Hierro
|
|||||
Cobre
|
|||||
cinc
|
9. Marca con V las opciones verdaderas y con F las falsas. Justifica éstas últimas
Los modelos atómicos son suposiciones de cómo se cree que son los átomos
| |
El número atómico está dado por el número de protones y electrones
| |
Todos los átomos de oxígeno tienen número másico 16
| |
El número másico está dado por el número de protones y neutrones
| |
La carga del átomo es positiva
| |
El núcleo tiene carga positiva
| |
Todos los átomos de magnesio tienen número atómico12
|
Para ejercitar modelos atómicos:
Símbolo
|
Z
|
A
|
p
|
e-
|
N
|
Configuración Electrónica
|
Zn
|
30
|
35
|
||||
Ni
|
59
|
28
|
||||
Ag
|
47
|
107
|
Pinta en la tabla periódica los metales con rojo, no metales con amarillo y gases nobles con azul

Confecciona un ideograma con las propiedades físicas de los metales, no metales y gases nobles
Indica 2 isótopos de los siguientes átomos. Indica en cada uno de ellos el número de protones, electrones y neutrones
C12
H 1
Mg 24
O 16
Cu 63
Grafica según modelo de Bohr el flúor y su isótopo
Escribe aplicaciones del C 14, deuterio, tritio
Escribe 2 metales del grupo II de la tabla periódica
Escribe 2 no metales del grupo VII de la tabla periódica
Escribe el gas noble correspondiente al periodo IV
Elemento
|
Número atómico
|
Grupo
|
Período
|
Metal
|
No metal
|
Gas Noble
|
II
|
3
|
|||||
17
|
4
|
|||||
VII
|
5
|
|||||
VIII
|
1
|
Elemento
|
M – NM- GN
|
Grupo
|
Período
|
Configuración electrónica
|
Estaño
| ||||
Platino
| ||||
Cloro
| ||||
Cobre
| ||||
Kriptón
| ||||
Helio
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
LEER artículo actualizado, luego responde ¿por qué es importante estudiar las moléculas del cuerpo humano?
http://www.muyinteresante.es/ino-mas-calvos
LEER http://www.muyinteresante.es/los-espermatozoides-hacen-calculos-matematicos-muy-complejos
¿qué elemento químico miden los espermatozoides?
http://www.muyinteresante.es/icomo-se-puede-averiguar-el-origen-de-una-cerveza
Donde
una o más sustancias se transforman en otras diferentes
|
|
En el
que los átomos de una o más sustancias se reordenan y forman otras sustancias
|
|
En el
que interviene energía
|
|
Puede
representarse por una ecuación química
|
El CO3H2 es el reactivo
|
|
El CO3H2
es el producto de la reacción
|
|
El CO3H2 es una sustancia diferente del CO2
|
Dos
moléculas de agua más una molécula de O2 dan dos moléculas de agua
|
|
Dos
átomos de H y uno de O2 dan dos de H2O
|
|
Dos
moléculas de hidrógeno reaccionan con una molécula de O2 y se
transforman en dos moléculas de agua
|
Las partículas reactivas deben
colisionar, pero solamente una cierta fracción del total de colisiones tiene
la energía suficiente y causar transformaciones de los reactivos en
productos.
|
|
Los reactivos
deben colisionar con un mínimo de
energía llamada energía de activación
|
|
Los átomos de las moléculas de los
reactivos deben estar siempre en movimiento, generando muchas colisiones
(choques). Parte de estas colisiones aumentan la velocidad de reacción
química. Cuantos más choques con energía y geometría adecuada exista, mayor
la velocidad de la reacción.
|
Las
reacciones exotérmicas
|
|
Liberan calor |
|
|
La energía de los reactivos en mayor
que la de los productos |
|
|
Absorben calor del medio |
La
velocidad de las reacciones químicas depende de
|
|
La temperatura |
|
|
El grado de división de los reactivos |
|
|
El número de moléculas en los
reactivos |
La siguiente
reacción 2N2 + 5O2
à 2 N2O5
se lee
|
|
Dos
moléculas de N2 más 5 moléculas de O2 dan dos moléculas
de N2O5 |
|
|
Dos átomos
de N2 y 5 de O2
dan dos de N2O5 |
|
|
Dos
moléculas de N2 reaccionan
con 5 moléculas de O2 y se transforman en dos moléculas de N2O5 |
Para que ocurra una reacción
química
|
|
Las partículas
reactivas deben colisionar, pero solamente una cierta fracción del total de
colisiones tiene la energía suficiente y causar transformaciones de los
reactivos en productos. |
|
|
Los
reactivos deben colisionar con un
mínimo de energía llamada energía de activación |
|
|
Los átomos de las
moléculas de los reactivos deben estar siempre en movimiento, generando
muchas colisiones (choques). Parte de estas colisiones aumentan la velocidad
de reacción química. Cuantos más choques con energía y geometría adecuada
exista, mayor la velocidad de la reacción. |
![]() La siguiente
reacción Ca (OH)2 CaO + H2O es de:
La siguiente
reacción Ca (OH)2 CaO + H2O es de:
|
|
Síntesis |
|
|
Descomposición |
|
|
Sustitución |
En una pila
|
|
La energía eléctrica se transforma en
energía química |
|
|
La energía química se transforma en
energía eléctrica |
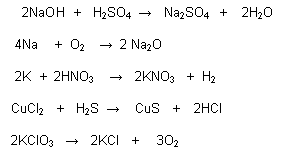
En las reacciones REDOX el elemento que gana electrones se reduce. Es el oxidante
|
En las reacciones de combustión el combustible es el oxígeno
|
En las reacciones de combustión el reactivo es CO2
|
El hierro se oxida debido a que ganó electrones del oxígeno
|
La actividad de los antisépticos y desinfectantes se basa en el principio de óxido reducción
|
Las margarinas, quesos, aceites toman gusto rancio al reaccionar con el oxígeno. Por ello debe usarse un antioxidante, por ejemplo vitamina E
|
En una pila se obtiene energía química a partir de la energía eléctrica
|
Energía eléctrica puede producir una reacción química
|
____________________________________________________________________
Completa las siguientes hemiecuaciones de oxidación y reducción con los electrones que intervienen y señala cuál es el agente oxidante y cuál es el reductor.
Leer:
http://www.muyinteresante.es/icomo-se-puede-averiguar-el-origen-de-una-cerveza
http://www.muyinteresante.es/ipor-que-huelen-tan-mal-la-col-y-la-coliflor-cuando-se-cuecen
http://www.muyinteresante.es/icomo-funcionan-las-comidas-autocalentables
http://www.muyinteresante.es/que-seas-perezoso-o-trabajador-depende-de-la-quimica-de-tu-cerebro
http://www.muyinteresante.es/ila-pimienta-negra-combate-la-obesidad
http://www.muyinteresante.es/el-cambio-climatico-se-puede-combatir-reciclando-emisiones-en-lugar-de-reducirlas
http://www.muyinteresante.es/los-aerosoles-afectan-al-clima-mas-de-lo-previsto
http://www.muyinteresante.es/inaugurado-en-paris-el-mayor-centro-de-investigacion-del-cabello
http://www.muyinteresante.es/iexisten-repelentes-de-tiburones
http://www.muyinteresante.es/ilas-palomitas-de-maiz-contienen-mas-oxidantes-que-la-fruta
http://www.muyinteresante.es/frank-sherwood-rowland-el-quimico-que-se-chivo-de-los-cfcs
http://www.muyinteresante.es/la-primera-enciclopedia-de-los-sabores
Leer
http://www.concienciaeco.com/2010/08/21/que-es-el-calentamiento-global/
- ¿Cuáles son los gases del efecto invernadero?
- Escribe las diferencias entre efecto invernadero y calentamiento global.
- En un gráfico indica con rojo los rayos entrantes a la atmósfera
Leer
PbO2
| Cu O | KOH | |||
H2SO3
| SO2 | Pt(OH)2 | |||
Na OH
| Al(OH)3 | CO2 | |||
CaO
| NO3H | SO4H2 | |||
Co(OH)2
| P2O5 | Cl2O5 |
Temas:

Confeccionar un power point con:
1) Estructura química del grupo químico
2) Propiedades
3) Diagrama de bloques del proceso de elaboración del alimento que contiene el grupo químico seleccionado.
4) Aportes a la alimentación
5) Elaborar un alimento que contenga el grupo químico elegido y compartirlo con el curso en la hora de química.
6) Explicar a los compañeros el power point confeccionado.
Componenetes del cuerpo humano
Completa:
1) 1 En total el cuerpo humano está formado por ________ elementos químicos
3) 2De esos 60, 4 elementos hacen el _____% de nuestro cuerpo
4) 3 Los 56 elementos restantes forman el _____%
5) 4 Los
4 elementos predominantes son _______, ______, _______, _____
6) 5 El
O forman el 65% es del cuerpohumano, pero unido la mayor parte unido al H que
forma el _________
7) 6 Nos
ayuda a regular la _____________ y la presión osmótica
8) 7 El
C 18% forman las moléculas orgánicas, carbohidratos, lípidos, __________, ARN
ADN. Es un componente básico de la vida.
9) 8 El
H es el 3° elemento más común. En la molécula de agua. Cumple una función en el
ADN, los enlaces de H son los que le dan la forma de _________________
___________
