REACCIONES REDOX
https://es.slideshare.net/LuisSeijo/reacciones-de-oxidacionreduccion-redox
BALANCEO DE ECUACIONES
https://www.slideshare.net/JavierAlexanderCucai/balanceo-de-ecuaciones-qumicas-por-mtodo-de-tanteo-algebraico-y-oxidoreduccin-lic-javier-cucaita
Celdas Galvánicas o celdas voltaicas
http://corinto.pucp.edu.pe/quimicageneral/contenido/42-celdas-galvanicas-o-celdas-voltaicas.html
QUÍMICA - Reacciones REDOX, Electrólisis, Pilas, Generador de Hidrogeno
https://www.youtube.com/watch?v=3Z3_0bElwCk
Evaluación de habilidades: estados de oxidación y reacciones redox
https://es.khanacademy.org/science/chemistry/oxidation-reduction/skill-checks-on-redox-reactions-and-electrochemistry/e/skill-check--oxidation-states-and-redox-reactions
Ajustar las siguientes reacciones redox por el método del número de oxidación
http://www.periodni.com/es/redox-ejercicios_de_practica.html
Galvanic Cell.swf Video
https://www.youtube.com/watch?v=C26pH8kC_Wk
experimento de galvani- UNSAAC
https://www.youtube.com/watch?v=Mulbf9W72ng&t=78s
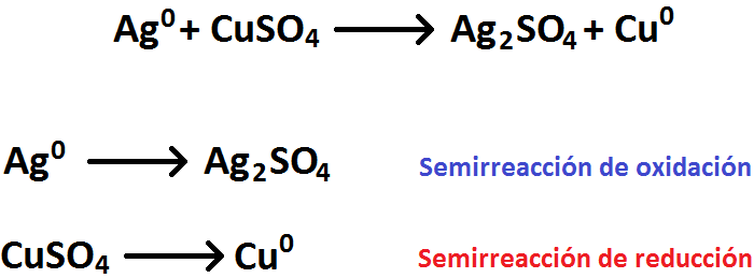
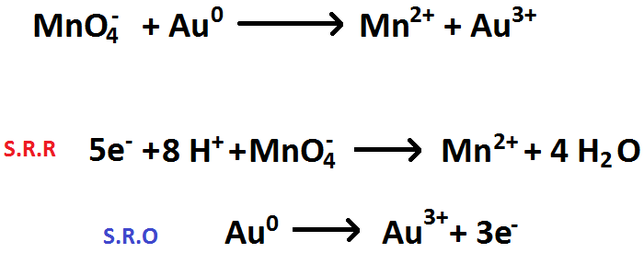
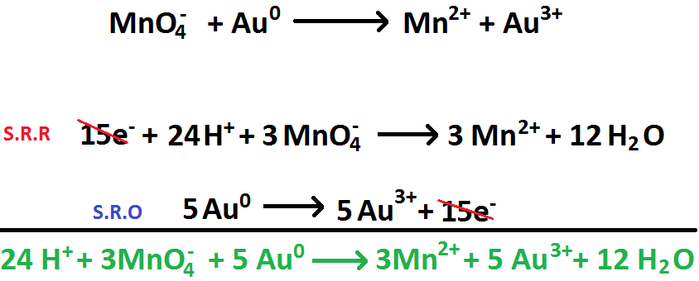
Ajustar las siguientes reacciones redox por el método del número de oxidación
...en medio ácido
- Ag + HNO3 = AgNO3 + NO2 + H2O
- Ag2S + HNO3(konc.) = AgNO3 + NO2 + S + H2O
- Ag2S + HNO3(razr.) = AgNO3 + NO + S + H2O
- As + HNO3 + H2O = H3AsO4 + NO
- As + NO3- = As2O5 + NO
en medio básico
Escribe V (verdadero) o F(falso) según corresponda
Las láminas de cobre y
cinc son electrodos
|
|
Los electrodos son la
superficie de contacto entre el conductor metálico y la solución de semicelda
(anódica o catódica).
|
|
Si el electrodo no
participan de la reacción redox (ni se oxida ni se reduce), se le llama
electrodo activo
|
|
El electrodo en el que
se produce la oxidación es el cátodo y en el que se lleva a cabo la reducción
es el ánodo
|
|
Los electrones quedan
libres a medida que el zinc metálico se oxida en el ánodo; fluyen a través
del circuito externo hacia el cátodo, donde se consumen conforme el Cu2+(ac)
se reduce.
|
|
Puesto que el Zn(s) se
oxida en la celda, el electrodo de zinc pierde masa y la concentración de
Zn2+(ac) en la solución aumenta con el funcionamiento de la celda
|
|
el electrodo de cobre
gana masa y la solución de Cu2+(ac) se hace menos concentrada a medida que el
éste se reduce a Cu(s).
|
|
Un puente salino se
compone de un tubo en forma de "U" que contiene una solución muy
concentrada de un electrólito, cuyos iones reaccionan con los otros iones de
la celda y con el material de los electrodos
|
|
La neutralidad
eléctrica se conserva al haber una migración de iones a través un puente
salino o a través de una barrera porosa que separa los dos compartimientos.
|
|
La oxidación se
produce en el cátodo y la reducción en el ánodo.
|
|
Los electrones fluyen
espontáneamente desde el ánodo positivo hacia el cátodo negativo.
|
|
El circuito eléctrico
se completa por el movimiento de los iones en solución: Los aniones se mueven
hacia el ánodo y los cationes hacia el cátodo
|
https://www.youtube.com/watch?v=4JnBtjpEbVI
Electrodo Normal de Hidrógeno
Standard hydrogen electrode
https://www.youtube.com/watch?v=ghvDcbCYJGU
https://www.youtube.com/watch?v=k_vR0Eqb5gY
Standard Hydrogen Electrode
Diagrama de pila galvánica y potencial estándar
https://www.youtube.com/watch?v=ddr9P0atHcI
http://www.uv.es/Tunon/Master_Ing_Bio/tema_5.pdf
Tabla de potenciales de reducción
Hemi-reacción EθV
Li+ + e- ⇄ Li -3.04
K+ + e- ⇄
K -2.92
Ba2+ + 2e- ⇄ Ba -2.90
Ca2+ + 2e- ⇄ Ca -2.87
Na+ + e- ⇄ Na -2.71
Mg2+ + 2e- ⇄ Mg -2.37
Al3+ + 3e- ⇄ Al -1.66
Mn2+ + 2e- ⇄ Mn -1.18
2H2O + 2e- ⇄ H2 (g) + 2 OH- -0.83
Zn2+ + 2e- ⇄ Zn -0.76
Cr2+ + 2e- ⇄ Cr -0.74
Fe2+ + 2e- ⇄ Fe -0.44
Cr3+ + 3e- ⇄ Cr -0.41
Cd2+ + 2e- ⇄ Cd -0.40
Co2+ + 2e- ⇄ Co -0.28
Ni2+ + 2e- ⇄ Ni -0.25
Sn2+ + 2e- ⇄ Sn -0.14
Pb2+ + 2e- ⇄ Pb -0.13
Fe3+ + 3e- ⇄ Fe -0.04
2H+ + 2e- ⇄ H2 (g) 0.00
|
S + 2H+ + 2e- ⇄ H2S (g) 0.14
Sn4+ + 2e- ⇄ Sn2+ 0.15
Cu2+ + e- ⇄ Cu+ 0.16
SO42+ + 4H+ + 2e- ⇄ SO2 (g) + 2H2O 0.17
Cu2+ + 2e- ⇄ Cu 0.34
2H2O + O2 + 4e- ⇄ 4OH- 0.40
Cu+ + e- ⇄ Cu 0.52
I2 + 2e- ⇄ 2I- 0.54
O2 (g) + 2H+ + 2e- ⇄ H2O2 0.68
Fe3+ + e- ⇄ Fe2+ 0.77
NO3- + 2H+ + e- ⇄ NO2 (g) + H2O 0.78
Hg2+ + 2e- ⇄ Hg (l) 0.78
Ag+ + e- ⇄ Ag 0.80
NO3- + 4H+ +3 e- ⇄ NO (g) + 2H2O 0.96
Br2 + 2e- ⇄ 2Br- 1.06
O2 (g) + 4H+ + 4e- ⇄ 2H2O 1.23
MnO2 + 4H+ + 2e- ⇄ Mn2+ + 2H2O 1.28
Cr2O72- + 14H+ + 6e- ⇄ 2Cr3+ + 7H2O 1.33
Cl2 + 2e- ⇄ 2Cl- 1.36
Au3+ + 3e- ⇄ Au 1.50
MnO4- + 8H+ + 5e- ⇄ Mn2+ + 4H2O 1.52
Co3+ + e- ⇄ Co2+ 1.82
F2 + 2e- ⇄ 2F- 2.87
|
Diagrama de pila galvánica y potencial estándar https://www.youtube.com/watch?v=ddr9P0atHcI
Principales procesos para el reciclaje de pilas y baterías
http://www.principia-malaga.com/p/images/potatoes/bateriademano/1bateriaasocia.htm
POTENCIAL DE ACCION
https://www.youtube.com/watch?v=NzcGwpyamq8
Potencial de acción y de reposo de las neuronas
https://www.youtube.com/watch?v=7P63Pl8kfqk
PROPAGACIÓN DEL POTENCIAL DE ACCIÓN
https://www.youtube.com/watch?v=iNnMXwaNX5g
La neurona (sencillo)
https://www.youtube.com/watch?v=VRR8ThukUD0
IMPULSO NERVIOSO Y CONTRACCION MUSCULAR
PROPAGACIÓN DEL POTENCIAL DE ACCIÓN
https://www.youtube.com/watch?v=iNnMXwaNX5g
La neurona (sencillo)
https://www.youtube.com/watch?v=VRR8ThukUD0
IMPULSO NERVIOSO Y CONTRACCION MUSCULAR
https://www.youtube.com/watch?v=zCzWozsdogk
Emociones
https://www.youtube.com/watch?v=plDprNhlM30
Fears | Facundo Manes | TEDxBuenosAires
Contracción Muscular
https://www.youtube.com/watch?v=JqYRV-TpcHA
POTENCIAL DE ACCION
https://www.youtube.com/watch?v=NzcGwpyamq8&t=118s
EFECTO DE LA CORRIENTE SOBRE EL ORGANISMO (JUEGO)
http://www.principia-malaga.com/p/images/potatoes/bateriademano/3bmanohuecos.htm
Propagación del impulso nervioso
https://www.youtube.com/watch?v=cn-HktrA6ZQ
Usar el cerebro. Conocer nuestra mente para vivir mejor
https://www.youtube.com/watch?v=cn-HktrA6ZQ
Usar el cerebro. Conocer nuestra mente para vivir mejor
https://www.youtube.com/watch?v=NC3A9agOYYQ
Streaming: ÁgilMente: aprende cómo funciona tu cerebro para potenciar tu creatividad y vivir mejor
https://www.youtube.com/watch?v=OufczQfFq74&t=1sNeurociencia: Toma de decisiones e innovación Dr. Facundo Manes #ForoLevel3 #SDE Argentina 2014
https://www.youtube.com/watch?v=O2gjpAXJ01Y&list=PLmyvNTShBKp07ObgJjWqRAKUO4N8Ri8oc
Medicina energética. Las bases científicas. Dr Manel Ballester - AETP
https://www.youtube.com/watch?v=-kguM76Ma-Q&t=1682s
Animales Sueltos - Estanislao Bachrach - Explicando Agilmente y En Cambio
https://www.youtube.com/watch?v=bWPR_WvNjC4
ESTANISLAO BACHRACH - ÁGILMENTE https://www.youtube.com/watch?v=1rxj_82eorg
Estanislao Bachrach en Human Camp Córdoba 2014 (su experiencia)
https://www.youtube.com/watch?v=1LFJVLMegEY
Mitos y Verdades del Cerebro en el Trabajo
https://www.youtube.com/watch?v=M-apqzIx2B4
¿Cómo funciona un Ph-metro?
https://www.youtube.com/watch?v=ssHslgjkDiA
Potentiometric pH measurement
https://www.youtube.com/watch?v=P1wRXTl2L3I
 Una sonda de medición de pH moderna típicamente es un electrodo combinado, el cual contiene tanto al electrodo de referencia como al electrodo de medición dentro de un mismo cuerpo. Un electrodo combinado consta de las siguientes partes.:
Una sonda de medición de pH moderna típicamente es un electrodo combinado, el cual contiene tanto al electrodo de referencia como al electrodo de medición dentro de un mismo cuerpo. Un electrodo combinado consta de las siguientes partes.:
https://es.wikipedia.org/wiki/Electrodo_de_vidrio
Animales Sueltos - Estanislao Bachrach - Explicando Agilmente y En Cambio
https://www.youtube.com/watch?v=bWPR_WvNjC4
ESTANISLAO BACHRACH - ÁGILMENTE https://www.youtube.com/watch?v=1rxj_82eorg
Estanislao Bachrach en Human Camp Córdoba 2014 (su experiencia)
https://www.youtube.com/watch?v=1LFJVLMegEY
Mitos y Verdades del Cerebro en el Trabajo
https://www.youtube.com/watch?v=M-apqzIx2B4
Ph-METRO
¿Cómo funciona un Ph-metro?
https://www.youtube.com/watch?v=ssHslgjkDiA
Potentiometric pH measurement
https://www.youtube.com/watch?v=P1wRXTl2L3I
 Una sonda de medición de pH moderna típicamente es un electrodo combinado, el cual contiene tanto al electrodo de referencia como al electrodo de medición dentro de un mismo cuerpo. Un electrodo combinado consta de las siguientes partes.:
Una sonda de medición de pH moderna típicamente es un electrodo combinado, el cual contiene tanto al electrodo de referencia como al electrodo de medición dentro de un mismo cuerpo. Un electrodo combinado consta de las siguientes partes.:- La parte sensitiva del electrodo, una burbuja hecha de un vidrio específico.
- Un electrodo interno, por lo general un electrodo de cloruro de plata o un electrodo de calomel saturado.
- Una solución interna tamponada, por lo general a pH=7 de KCl 0,1 molar para electrodos de pH, o 0,1 molar de MeCl para un electrodo pMe.
- Cuando se utiliza un electrodo de cloruro de plata, una pequeña cantidad de AgCl puede precipitar en el interior del electrodo de vidrio.
- Un electrodo de referencia, por lo general del mismo tipo que el 2.
- Una solución de referencia interna, por lo general 0,1 mol/l KCl
- Unión con la solución estudiada, por lo general hecha de cerámica, o un capilar relleno de fibra de asbestos o fibra de cuarzo.
- Cuerpo del electrodo, hecho de vidrio no conductivo o plástico.
La parte inferior del electrodo de pH termina en una burbuja redonda de vidrio delgado. El electrodo de pH, puede pensarse como un tubo dentro de un tubo. El tubo más interno, contiene una solución invariable de HCl 1×10−7 mol/l. También dentro de este tubo interno se encuentra el polo catódico de la sonda de referencia. El polo anódico se envuelve alrededor de la parte exterior del tubo interno y termina en una sonda de referencia del mismo tipo que la que se encuentra en el interior del tubo. Esta se encuentra llena con una solución de referencia de KCl 0,1 mol/l y se encuentra en contacto con la solución que se encuentra en el exterior de la sonda de pH por medio de un conducto poroso que hace las veces de puente salino.
Electrolisis-reacciones en disolución acuosa y leyes de Faraday
https://www.youtube.com/watch?v=5eCU7I72zC4
https://es.slideshare.net/ALEX198420/unidad-v-electroquimica
https://www.fisicanet.com.ar/quimica/electrolisis/ap07_electrolisis.php
https://www.fisicanet.com.ar/quimica/electrolisis/ap07_electrolisis.php
LINEA DE CROMADO Y GALVANIZADO
QUIMICA Electrolisis 02 BACHILLERATO Ley de Faraday
ejercicio resuelto electrolisis y ley de Faraday
CORROSION GALVANICA
Disminuir la corrosión
Stainless Steel Against Corrosion-PART 2-3-GALVANIC CORROSION
Acero inoxidable - Resistencia a la corrosión.
https://www.youtube.com/watch?v=t0Ngs6QQiRM
Tipos de corrosión
https://www.youtube.com/watch?v=MlIeEfW6jnA
https://www.youtube.com/watch?v=cIGJX3PfIsY
Inhibiendo la herrumbre y corrosión para evitar fallas de las máquinas
8 de noviembre de 2013
La corrosión le cuesta a las compañías millones de dólares cada año. Mucho de esto se debe a la corrosión del hierro y el acero. Al exponerlos a la humedad y oxígeno, el hierro y el acero reaccionarán, formando un óxido. Este óxido no se adhiere con firmeza a la superficie del metal y se deprenderá como hojuelas, causando picaduras (pitting) en la superficie de la maquinaria. El pitting intenso puede debilitar y desintegrar el metal, llevando a la falla.
62% | De los visitantes a machinerylubrication.com dicen que el agua es el factor que incide con más posibilidades como causante de corrosión en los componentes de la maquinaria en sus plantas. |
Obviamente, debido al involucramiento del agua, la herrumbre se presentará con más rapidez en condiciones de humedad. Sin embargo, hay algunos factores que determinan la tasa de corrosión. Un ejemplo es la presencia de sal. La sal disuelta incrementa la conductividad de la solución acuosa formada en la superficie del metal e intensifica la tasa de erosión electroquímica. Otro ejemplo es el calor; mientras más alta es la temperatura, mayor será la tasa de corrosión.
La formación de herrumbre es un proceso muy complejo que se inicia con la oxidación del hierro a iones de hierro (hierro “+2”).
Fe → Fe+2 + 2 e-
Para la siguiente secuencia de reacciones, se requieren tanto el agua como el oxígeno. Los iones de hierro (+2) se oxidan para formar iones férricos (hierro “+3”).
Fe+2 → Fe+3 + 1 e-
Los electrones que se originan en los dos pasos anteriores se utilizan para reducir oxígeno.
O2 (g) + 2 H2O + 4e- → 4 OH-
Los iones férricos se combinan entonces con oxígeno para formar óxido férrico, el cual es hidratado con variadas cantidades de agua.
En términos de la ley de Layman: Hierro + Oxígeno + Agua = Óxido de hierro hidratado (herrumbre)
Puede presentarse otro tipo de corrosión en los componentes de la maquinaria, llamada corrosión con ácidos orgánicos. Esos ácidos orgánicos se forman de múltiples maneras y pueden incluso ser un subproducto del envejecimiento del aceite (oxidación). Estos ácidos son débiles comparados con los ácidos inorgánicos comunes, pero aun así se hidratarán lo suficiente como para dañar a la mayoría de los metales.
Un ejemplo es el ácido acético. Es ligeramente corrosivo a los metales, incluyendo el hierro, magnesio y zinc, produciendo hidrógeno y una sal llamada acetato:
Fe + 2 CH3COOH → (CH3COO)2 Fe + H2
En términos de la ley de Layman: Hierro + Ácido orgánico = Acetato de hierro + Hidrógeno
Opciones de inhibidores de corrosión
Los inhibidores de corrosión pueden estar en diferentes formas y con variadas funciones para proteger a la maquinaria. Los inhibidores de corrosión fase líquida aseguran que las superficies cubiertas por el fluido estarán protegidas por los robustos aditivos en el fluido. La protección fase vapor puede incluirse con la protección fase líquida o emplearse en reservorios secos. Trabajan llenando el espacio superior con un vapor que previene la corrosión. Los recubrimientos de superficies protegen a los sistemas adhiriéndose a la superficie expuesta. Generalmente, los recubrimientos de superficie repelen el agua e incluyen un aditivo para reducir la corrosión de la superficie.
Inhibidores de herrumbre y corrosión
La mejor manera de frenar la herrumbre es impidiendo que el metal entre en contacto con el agua, oxígeno o ácidos. En esencia, esto es exactamente lo que hacen los inhibidores de herrumbre y corrosión. Esos aditivos son compuestos que tienen una elevada atracción polar hacia las superficies metálicas. Se adhieren químicamente a la superficie, formando una capa protectora sobre el metal. Esta película actúa como una barrera que no permite que el metal entre en contacto físico con cualquier sustancia que pudiera promover la corrosión. Algunos de los compuestos más empleados son las succinamidas y sulfonatos alcalinos.
Si no puede impedirse la formación de herrumbre, las partículas de herrumbre pueden desprenderse y contribuir a generar desgaste abrasivo. El óxido de hierro es mucho más duro que las superficies de acero que entran en contacto con este, por lo que pueden presentarse elevadas cantidades de desgaste por abrasión de tres cuerpos.
Abrasión de tres cuerpos
Las propiedades de protección a la corrosión pueden ser difíciles de evaluar y son un tanto subjetivas. Para mejores resultados, el laboratorio debe pulir un espécimen de prueba e inmediatamente cubrirlo con el aceite a probar. Después de recubrirlo, el laboratorio puede someter el espécimen a las diferentes condiciones que acompañan a la formación de herrumbre. El ensayo ASTM D665, a pesar de estar referido con el nombre “Características preventivas de herrumbre de aceites para turbinas de vapor”, puede emplearse para cualquier formulación de aceite. En este ensayo, un espécimen de acero se sumerge en una mezcla de agua destilada o agua sintética de mar durante 24 horas; la mezcla se agita y se revisa la cantidad de herrumbre formada.
La herrumbre y la corrosión son perjudiciales para su programa de confiabilidad. Recuerde atacar siempre las causas raíz. Elimine las causas raíz de falla y así reducirá la posibilidad de que esa falla se presente.









No hay comentarios:
Publicar un comentario